外泌体在人体内参与着细胞间的能量转换,信息识别与传递,物质运送等基本生命过程。外泌体就像是人体细胞间的通讯体系,完成着在细胞之间传递各种分子的使命。外泌体的生物学意义已经得到了充分的研究,其在疾病诊断和治疗中得到了极大的发展。
在过去几年中,少数研究单位已经使用外泌体进行了小规模的、首次人类Ⅰ期临床试验。在可获得的研究结果情况下,均发现外泌体治疗是安全且耐受性良好的。外泌体具有强大的再生特性,包括促进伤口愈合、刺激中风后脑损伤的修复。目前已有许多公司正在推进外泌体向临床阶段的研究。

本篇主要对外泌体中蛋白质和核酸在疾病诊断中的应用、外泌体作为载体参与肿瘤疾病或免疫性疾病治疗中的应用进行概述。
外泌体在疾病诊断中的应用
随着研究不断深入,在各种健康与疾病模型中均发现,外泌体通过分子信息传递扮演着重要角色,更多的时候被认为是疾病的生物标志物和预后因子,具有重要的疾病临床诊断意义。
从外泌体的形成过程中可以发现,通过分析外泌体的组分,可以帮助研究人员探索原始细胞的信息。研究人员利用外泌体这一特性,积极应用到心血管疾病、中枢神经系统疾病、肿瘤以及肝肾等相关疾病的分子诊断方法。
1.肿瘤来源外泌体用于早期诊断
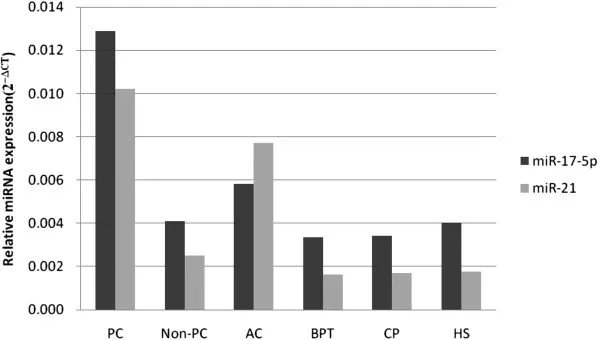
有研究表明外泌体中携带的肿瘤来源DNA片段有助于肿瘤相关DNA突变的检测。肿瘤来源的外泌体由肿瘤细胞分泌,其携带的遗传信息与肿瘤组织一致,并且存在于生物体的各种体液中,故可以用于肿瘤的早期诊断,特异性更强;另外肿瘤来源外泌体的含量及所含的miRNA差异表达,可以用来判断肿瘤的良恶性程度,例如Que等通过比较胰腺癌和正常人血清外泌体中miRNA-17-5p、miRNA-21、miRNA-155和miRNA-196a的水平,发现胰腺癌患者中miRNA-17-5p和miRNA-21的含量显著升高,尤其是高水平的miRNA-17-5p与胰腺癌分期较晚有显著关系。
2.作为肿瘤诊断标记
对外泌体的研究逐渐从将外泌体用作靶向肿瘤细胞的基因工程疫苗转向用作肿瘤诊断标记。近年来学者们对PD-L1的研究甚是过热,作为一种跨膜蛋白,通过与受体PD-1结合后,抑制T细胞的活化以达到维持免疫稳态。而肿瘤细胞高表达PD-L1与活化的T细胞表达的PD-1受体结合则导致免疫逃避。流式细胞术和免疫荧光结果表明PD-L1不仅存在于囊泡表面,而且存在于囊泡样结构中,可在Rab27a和nSMase的协助下包装形成外泌体,故外泌体PD-L1可以作为肿瘤生物标志物用于临床诊断相关疾病。

3.作为预后判断指标
有临床试验研究表明,外泌体可能成为进展期非小细胞肺癌和结直肠癌的预后判断指标。此外,有研究表明通过研究外泌体介导的磷酸戊糖途径在卵巢癌转移中的蛋白质组学分析,发现关键蛋白葡萄糖-6-磷酸 脱氢酶、转酮醇酶和醛醇酶1对晚期卵巢癌的诊断、不良后果和治疗靶点具有重要意义。
外泌体在疾病治疗中的应用
外泌体起初被认为是细胞分泌出的“垃圾”,通过该方式被抛弃。然而在接下来的研究中发现,外泌体的功能愈发重要,比如细胞间的信号传送,外泌体可由生物体内各种细胞分泌,包括体内的免疫细胞。研究人员凭借外泌体的功能特征,建立了免疫细胞衍生的外泌体肿瘤免疫治疗策略,以及外泌体用于药物递送系统等。
1.MSC来源的外泌体用于疾病治疗
外泌体应用于疾病治疗的前景广阔,目前有研究表明,MSC来源的外泌体本身就具有治疗作用,在使用MSC来源的外泌体治疗一名移植物抗宿主病患者表明,重复注射具有良好的耐受性,没有明显的副作用。
2.外泌体作为药物载体
有报道治疗癌症的一些化疗化合物被装载到外泌体后用于癌症治疗,并在小鼠上进行了测试,发现具有良好的抗肿瘤效果和低毒性,例如,通过装载紫杉醇的巨噬细胞来源的外泌体来诱导小鼠的肺肿瘤反应。
外泌体在作为细胞间通讯的一种形式时,可将蛋白质、脂类等运送到周围环境中,参与许多生理病理过程。而在肿瘤微环境中,可分泌外泌体的细胞包括:癌细胞、成纤维细胞、免疫细胞,这些细胞分泌的外泌体将内容物运载到微环境中,促进血管生成,调节基质反应和免疫反应。另外在肿瘤微环境中,具有抗药性的细胞通过传递核酸给敏感的癌细胞,对其基因进行mRNA水平的调节。

对于普通药物来说,通常在进入体内后仅有少部分才能真正作用于病变部位,这也是药物疗效和毒副作用的根本原因。鉴于此,获得精准靶向的药物也是目前药物涉及的重点。外泌体作为天然的胞间信息载体,相对较小的分子结构,具有生物相容性和生物降解性,毒性低,不引起毒性免疫反应,在药物载体领域存在巨大的应用潜力:
不同来源的外泌体表面分子不一,对受体细胞有选择性,治疗多样性。
相对于脂质体对亲水性物质的低包装效率,外泌体可显著提高包装效率。
特殊细胞的外泌体可避免产生免疫反应。
同样对于外泌体作为药物载体的选择遵循两大基本原则:
保持内含药物在体内环境中的活性。
在不引发机体对药物载体产生免疫反应的情况下释放内含物。
3.外泌体作为基因编辑的载体
外泌体circRNA作为肿瘤微环境和肿瘤免疫治疗成为近年来生命科学研究热点,也是国家自然基金申请的重点领域。复杂的外泌体工程可能成为控制原发肿瘤和转移性疾病提供新的治疗机会。有报道称将外泌体作为载体递送CRISPR/Cas9的质粒到癌细胞中,而这种癌细胞产生的外泌体会在小鼠的卵巢癌肿瘤细胞中富集,因此可以很好地靶向递送质粒,由CRISPR/Cas9介导的基因编辑会抑制多聚ADP-核糖聚合酶-1的表达,同时结合化学药物联合治疗可以诱导卵巢癌细胞的凋亡,降低癌细胞的活力,该项研究证明了外泌体可以作为基因编辑的载体进行治疗。
外泌体在疾病治疗方面展现出巨大的潜力,对于天然的外泌体用作载体来说,携带药物或者相关基因有限,通过结合生物工程改造可以形成一个新型的药物携带工具,是一种十分具有潜力的疾病治疗手段。目前已有研究证明改造的外泌体在癌症疾病和免疫性疾病中均具有较好的应用,也期待在基础研究和临床试验中得到更多的应用。

References
Madeline A. Lancaster, Juergen A. Knoblich. Organogenesis in a dish: Modeling development and disease using organoid technologies[J]. Science, 2014, 345(6194).
Toshiro Sato, Robert G. Vries, Hugo J. Snippert, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche[J]. Nature: International weekly journal of science, 2009, 459(7244).
Jarno Drost, Hans Clevers. Organoids in cancer research[J]. Nature Reviews Cancer, 2018, 18.
Park Sunghee Estelle, Georgescu Andrei, Huh Dongeun. Organoids-on-a-chip.[J]. Science (New York, N.Y.), 2019, 364(6444):960-965.
Shahbazi Marta N, Siggia Eric D, ZernickaGoetz Magdalena. Self-organization of stem cells into embryos: A window on early mammalian development. [J]. Science (New York, N.Y.), 2019, 364(6444):948-951.
Frans Schutgens, Hans Clevers. Human Organoids: Tools for Understanding Biology and Treating Diseases[J]. Annual Review of Pathology: Mechanisms of Disease, 2020, 15.
Que, R., Ding, G., Chen, J. et al. Analysis of serum exosomal microRNAs and clinicopathologic features of patients with pancreatic adenocarcinoma. World J Surg Onc. 2013, 11: 219.
https://www.cellgs.com.
https://clinicaltrials.gov.


地址:天津市高新技术产业园区海泰创新六路2号
电话:022-2379-6163
邮箱:info@zhongaobio.com


Copyright © 2020 ZhongAoBio. All rights reserved. 津ICP备14005123号-1 津公网安备12011602300555号

扫一扫
关注微信公众号


